 La entropía puede parecer un concepto misterioso y difícil de entender, que comúnmente se relaciona con el desorden. Sin embargo, si nos adentramos en el significado de éste, no sólo veremos que se entiende fácilmente, sino que además encierra una serie de sutilezas que lo hacen muy interesante.
La entropía puede parecer un concepto misterioso y difícil de entender, que comúnmente se relaciona con el desorden. Sin embargo, si nos adentramos en el significado de éste, no sólo veremos que se entiende fácilmente, sino que además encierra una serie de sutilezas que lo hacen muy interesante.
Antes de comenzar a explicar la entropía y ver qué relación real tiene ésta con el nivel de desorden, debemos hacer una pequeña y fácil introducción a la física estadística: diferenciar entre microestados y macroestados. ¡Pero no os asustéis! Aunque ahora hablaré de sistemas físicos como un gas en una botella y de magnitudes físicas como temperatura, volumen, etc. al final veremos de qué manera todo esto lo podremos extrapolar a cosas aún más cercanas.
Oxígeno en una botella
Pues bien, supongamos que tenemos un gas, por ejemplo oxígeno, dentro de una botella, a una temperatura de 25ºC. Como sabemos, los gases están compuestos por partículas más pequeñas, moléculas, que se van moviendo libremente ocupando todo el espacio en el que están encerrados (y si no están encerrados, expandiéndose indefinidamente). Esas partículas en movimiento estarán constantemente rebotando con las paredes de la botella y chocando entre sí. Además, cuanto mayor sea la temperatura, con más velocidad se moverán esas moléculas y con más fuerza chocarán contra las paredes de la botella -de hecho, lo que percibimos como temperatura es en realidad un movimiento microscópico de agitación de las moléculas-.
 Lo interesante del caso, es que si pudiéramos tomar una serie de «fotos», cada una de las cuales captando la velocidad y posición de todas las moléculas para esta temperatura de la botella (25ºC), veríamos que éstas irían variando de una manera muy caótica en cada instantánea. Es decir, en la primera «foto» cada una de las moléculas tendrá una velocidad y una posición, y en la segunda, un segundo después, debido a la gran agitación de las moléculas, la velocidad y posición de cada una de ellas será muy diferente. Obtendríamos así millones de «fotos» distintas donde la posición y velocidad de cada una de las partículas, para la misma temperatura dada, serían muy diferentes (por supuesto, en la realidad no es posible tomar dichas fotos, pero si pudiéramos sabemos que éste sería el resultado).
Lo interesante del caso, es que si pudiéramos tomar una serie de «fotos», cada una de las cuales captando la velocidad y posición de todas las moléculas para esta temperatura de la botella (25ºC), veríamos que éstas irían variando de una manera muy caótica en cada instantánea. Es decir, en la primera «foto» cada una de las moléculas tendrá una velocidad y una posición, y en la segunda, un segundo después, debido a la gran agitación de las moléculas, la velocidad y posición de cada una de ellas será muy diferente. Obtendríamos así millones de «fotos» distintas donde la posición y velocidad de cada una de las partículas, para la misma temperatura dada, serían muy diferentes (por supuesto, en la realidad no es posible tomar dichas fotos, pero si pudiéramos sabemos que éste sería el resultado).
Cada una de estas «fotos» es lo que llamamos un microestado. Es decir, la velocidad y posición de todas y cada una de la partícula en un instante con la botella a 25ºC es un microestado, que a su vez es diferente del microestado en un instante posterior para la misma temperatura de la botella. Por tanto, existe un conjunto de microestados para la temperatura de 25ºC, es decir, un conjunto de «fotos» posibles de la velocidad y posición de cada una de las partículas cuando la botella está a 25ºC.
Lo interesante del tema es que si, por ejemplo, aumentáramos la temperatura de la botella a 40ºC, las partículas se moverían con más velocidad, y el conjunto de microestados o «fotos» que obtendríamos sería diferente a cuando la teníamos a 25ºC.
Y aquí entra la definición del macroestado: es el estado que podemos medir con un simple termómetro (es decir, el estado macroscópico, estado físico, o simplemente, estado). En nuestro ejemplo, un macroestado sería la botella a una temperatura dada. Si cambiamos la temperatura, tendríamos un macroestado diferente.
Por tanto, y esto es muy importante, vemos que cada macroestado (es decir, cada temperatura de la botella) tiene asociado un conjunto diferente de microestados (es decir, una serie de posibilidades de posición y velocidad de todas las partículas).
Congelamos la botella
 Metamos ahora la botella en un supercongelador donde bajamos su temperatura hasta -220ºC; haciendo así que el oxígeno se congele, se solidifique.
Metamos ahora la botella en un supercongelador donde bajamos su temperatura hasta -220ºC; haciendo así que el oxígeno se congele, se solidifique.
¿Qué ocurre en un sólido? Las partículas que lo componen ya no se mueven como en un gas, sino que están quietas siempre en la misma posición. Además, estas posiciones están más o menos definidas, es decir, una vez localizas un átomo de oxígeno, puedes saber aproximadamente donde estará el otro, pues en un sólido las partículas forman enlaces que las mantienen aproximadamente en su sitio. Por ello, podemos afirmar que un sólido está más ordenado que en un gas.
En el sólido, puesto que las partículas están quietas y más o menos ordenadas, el conjunto de velocidades y posiciones posibles será menor que en un gas. O, lo que es lo mismo, el número de microestados del oxígeno sólido en la botella es mucho menor que el número de microestados de un gas.
Un poco de matemáticas
Hemos visto que hay una relación entre el número de microestados y el orden. Cuantos más microestados tiene un macroestado, más desordenado está, porque más posiciones y velocidades distintas pueden tener sus partículas. Teniendo en cuenta esta relación entre microestados y macroestados, el genial físco Ludwig Boltzmann, a finales del siglo XIX, busca una magnitud física que dé cuenta del orden interno de un estado; y así define la entropía S de un macroestado como:
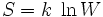
donde S es la entropía, k es un valor constante, y W es el número de estados.
¡Un momento! Dirá el lector menos acostumbrado a las fórmulas. ¿Qué significa esta ecuación? ¿Por qué decide Boltzmann que la entropía se defina así y no de otra manera?
La primera pregunta se resuelve fácilmente: lo que esta ecuación significa es que la entropía S de un estado físico crece con el número posible de microestados, W. La manera en la que S crece con W se ve muy bien en la siguiente gráfica:

La segunda cuestión es algo más técnica y simplemente diré que ésa es la única ecuación que cumple una serie de propiedades lógicas y necesarias.
Ropa tirada
 Para ver mejor la relación entre la entropía y el orden, apliquemos lo aprendido a algo más cotidiano. Intuitivamente, ¿qué está más ordenado? ¿la ropa dentro del cajón o la ropa desperdigada por la habitación? El macroestado «ropa dentro del cajón» tiene mucho menos microestados posibles que el macroestado «ropa desperdigada por la habitación» por la sencilla razón de que fuera del cajón existen muchas más posiciones posibles de la ropa; es decir, existen muchos más microestados. Por tanto, podemos decir que «ropa fuera del cajón» tiene más entropía que «ropa dentro del cajón».
Para ver mejor la relación entre la entropía y el orden, apliquemos lo aprendido a algo más cotidiano. Intuitivamente, ¿qué está más ordenado? ¿la ropa dentro del cajón o la ropa desperdigada por la habitación? El macroestado «ropa dentro del cajón» tiene mucho menos microestados posibles que el macroestado «ropa desperdigada por la habitación» por la sencilla razón de que fuera del cajón existen muchas más posiciones posibles de la ropa; es decir, existen muchos más microestados. Por tanto, podemos decir que «ropa fuera del cajón» tiene más entropía que «ropa dentro del cajón».
El desorden crece
En general, si quitamos restricciones a un sistema la entropía crece. Si no ponemos la ropa en el cajón y la vamos tirando por la habitación todo estará más desordenado. Si abrimos la botella de oxígeno a 25ºC el gas saldrá de la botella, expandiéndose, ocupando más espacio, y por ello aumentando el número de microestados posibles y su entropía. Si cogemos un saco de canicas y lo rasgamos todas las canicas caerán, desordenándose, aumentando sus posiciones posibles y aumentando la entropíá.
De hecho, hay una ley fundamental de la Naturaleza que dice que en todo proceso natural la entropía crece. Y ahora, que sabemos qué es la entropía, podemos decir que esto es así porque el número de microestados posibles es cada vez mayor.
¿Lo has entendido? ¡¡Pues a ordenar tu cuarto!!
PD: Esta anotación surge como consecuencia tardía y no gráfica de la petición que realiza Luis en su entretenido y creativo blog Entropía.
 «Se han imaginado muchos ejemplos para familliarizar al público con esta idea, pero ninguno es más sorprendente que el empleado por Lord Kelvin: supongamos que pudiéramos marcar las moléculas de un vaso de agua; vertamos entonces el contenido del vaso en el océano y agitemos de forma que las moléculas marcadas se distribuyan uniformemente por los siete mares; si después llenamos un vaso de agua en cualquier parte del océano, encontraremos en él alrededor de un centenar de moléculas marcadas.»
«Se han imaginado muchos ejemplos para familliarizar al público con esta idea, pero ninguno es más sorprendente que el empleado por Lord Kelvin: supongamos que pudiéramos marcar las moléculas de un vaso de agua; vertamos entonces el contenido del vaso en el océano y agitemos de forma que las moléculas marcadas se distribuyan uniformemente por los siete mares; si después llenamos un vaso de agua en cualquier parte del océano, encontraremos en él alrededor de un centenar de moléculas marcadas.» Cuando una teoría que intenta explicar la naturaleza comienza a dar resultados que no concuerdan con lo que medimos, ¡es un buen momento para cambiarla por otra nueva!
Cuando una teoría que intenta explicar la naturaleza comienza a dar resultados que no concuerdan con lo que medimos, ¡es un buen momento para cambiarla por otra nueva! Pero justo en el año 1900, a
Pero justo en el año 1900, a  Lo que comenzó siendo un «truco matemático» tiene tantas implicaciones dentro de la física, que todavía, más de un siglo después, no logramos comprender muchas de ellas.
Lo que comenzó siendo un «truco matemático» tiene tantas implicaciones dentro de la física, que todavía, más de un siglo después, no logramos comprender muchas de ellas. La
La  Lo interesante del caso, es que si pudiéramos tomar una serie de «fotos», cada una de las cuales captando la velocidad y posición de todas las moléculas para esta temperatura de la botella (25ºC), veríamos que éstas irían variando de una manera muy caótica en cada instantánea. Es decir, en la primera «foto» cada una de las moléculas tendrá una velocidad y una posición, y en la segunda, un segundo después, debido a la gran agitación de las moléculas, la velocidad y posición de cada una de ellas será muy diferente. Obtendríamos así millones de «fotos» distintas donde la posición y velocidad de cada una de las partículas, para la misma temperatura dada, serían muy diferentes (por supuesto, en la realidad no es posible tomar dichas fotos, pero si pudiéramos sabemos que éste sería el resultado).
Lo interesante del caso, es que si pudiéramos tomar una serie de «fotos», cada una de las cuales captando la velocidad y posición de todas las moléculas para esta temperatura de la botella (25ºC), veríamos que éstas irían variando de una manera muy caótica en cada instantánea. Es decir, en la primera «foto» cada una de las moléculas tendrá una velocidad y una posición, y en la segunda, un segundo después, debido a la gran agitación de las moléculas, la velocidad y posición de cada una de ellas será muy diferente. Obtendríamos así millones de «fotos» distintas donde la posición y velocidad de cada una de las partículas, para la misma temperatura dada, serían muy diferentes (por supuesto, en la realidad no es posible tomar dichas fotos, pero si pudiéramos sabemos que éste sería el resultado). Metamos ahora la botella en un supercongelador donde bajamos su temperatura hasta -220ºC; haciendo así que el oxígeno se congele, se solidifique.
Metamos ahora la botella en un supercongelador donde bajamos su temperatura hasta -220ºC; haciendo así que el oxígeno se congele, se solidifique.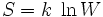

 Para ver mejor la relación entre la entropía y el orden, apliquemos lo aprendido a algo más cotidiano. Intuitivamente, ¿qué está más ordenado? ¿la ropa dentro del cajón o la ropa desperdigada por la habitación? El macroestado «ropa dentro del cajón» tiene mucho menos microestados posibles que el macroestado «ropa desperdigada por la habitación» por la sencilla razón de que fuera del cajón existen muchas más posiciones posibles de la ropa; es decir, existen muchos más microestados. Por tanto, podemos decir que «ropa fuera del cajón» tiene más entropía que «ropa dentro del cajón».
Para ver mejor la relación entre la entropía y el orden, apliquemos lo aprendido a algo más cotidiano. Intuitivamente, ¿qué está más ordenado? ¿la ropa dentro del cajón o la ropa desperdigada por la habitación? El macroestado «ropa dentro del cajón» tiene mucho menos microestados posibles que el macroestado «ropa desperdigada por la habitación» por la sencilla razón de que fuera del cajón existen muchas más posiciones posibles de la ropa; es decir, existen muchos más microestados. Por tanto, podemos decir que «ropa fuera del cajón» tiene más entropía que «ropa dentro del cajón».

 Uno de ellos fue
Uno de ellos fue 

