 La entropía puede parecer un concepto misterioso y difícil de entender, que comúnmente se relaciona con el desorden. Sin embargo, si nos adentramos en el significado de éste, no sólo veremos que se entiende fácilmente, sino que además encierra una serie de sutilezas que lo hacen muy interesante.
La entropía puede parecer un concepto misterioso y difícil de entender, que comúnmente se relaciona con el desorden. Sin embargo, si nos adentramos en el significado de éste, no sólo veremos que se entiende fácilmente, sino que además encierra una serie de sutilezas que lo hacen muy interesante.
Antes de comenzar a explicar la entropía y ver qué relación real tiene ésta con el nivel de desorden, debemos hacer una pequeña y fácil introducción a la física estadística: diferenciar entre microestados y macroestados. ¡Pero no os asustéis! Aunque ahora hablaré de sistemas físicos como un gas en una botella y de magnitudes físicas como temperatura, volumen, etc. al final veremos de qué manera todo esto lo podremos extrapolar a cosas aún más cercanas.
Oxígeno en una botella
Pues bien, supongamos que tenemos un gas, por ejemplo oxígeno, dentro de una botella, a una temperatura de 25ºC. Como sabemos, los gases están compuestos por partículas más pequeñas, moléculas, que se van moviendo libremente ocupando todo el espacio en el que están encerrados (y si no están encerrados, expandiéndose indefinidamente). Esas partículas en movimiento estarán constantemente rebotando con las paredes de la botella y chocando entre sí. Además, cuanto mayor sea la temperatura, con más velocidad se moverán esas moléculas y con más fuerza chocarán contra las paredes de la botella -de hecho, lo que percibimos como temperatura es en realidad un movimiento microscópico de agitación de las moléculas-.
 Lo interesante del caso, es que si pudiéramos tomar una serie de «fotos», cada una de las cuales captando la velocidad y posición de todas las moléculas para esta temperatura de la botella (25ºC), veríamos que éstas irían variando de una manera muy caótica en cada instantánea. Es decir, en la primera «foto» cada una de las moléculas tendrá una velocidad y una posición, y en la segunda, un segundo después, debido a la gran agitación de las moléculas, la velocidad y posición de cada una de ellas será muy diferente. Obtendríamos así millones de «fotos» distintas donde la posición y velocidad de cada una de las partículas, para la misma temperatura dada, serían muy diferentes (por supuesto, en la realidad no es posible tomar dichas fotos, pero si pudiéramos sabemos que éste sería el resultado).
Lo interesante del caso, es que si pudiéramos tomar una serie de «fotos», cada una de las cuales captando la velocidad y posición de todas las moléculas para esta temperatura de la botella (25ºC), veríamos que éstas irían variando de una manera muy caótica en cada instantánea. Es decir, en la primera «foto» cada una de las moléculas tendrá una velocidad y una posición, y en la segunda, un segundo después, debido a la gran agitación de las moléculas, la velocidad y posición de cada una de ellas será muy diferente. Obtendríamos así millones de «fotos» distintas donde la posición y velocidad de cada una de las partículas, para la misma temperatura dada, serían muy diferentes (por supuesto, en la realidad no es posible tomar dichas fotos, pero si pudiéramos sabemos que éste sería el resultado).
Cada una de estas «fotos» es lo que llamamos un microestado. Es decir, la velocidad y posición de todas y cada una de la partícula en un instante con la botella a 25ºC es un microestado, que a su vez es diferente del microestado en un instante posterior para la misma temperatura de la botella. Por tanto, existe un conjunto de microestados para la temperatura de 25ºC, es decir, un conjunto de «fotos» posibles de la velocidad y posición de cada una de las partículas cuando la botella está a 25ºC.
Lo interesante del tema es que si, por ejemplo, aumentáramos la temperatura de la botella a 40ºC, las partículas se moverían con más velocidad, y el conjunto de microestados o «fotos» que obtendríamos sería diferente a cuando la teníamos a 25ºC.
Y aquí entra la definición del macroestado: es el estado que podemos medir con un simple termómetro (es decir, el estado macroscópico, estado físico, o simplemente, estado). En nuestro ejemplo, un macroestado sería la botella a una temperatura dada. Si cambiamos la temperatura, tendríamos un macroestado diferente.
Por tanto, y esto es muy importante, vemos que cada macroestado (es decir, cada temperatura de la botella) tiene asociado un conjunto diferente de microestados (es decir, una serie de posibilidades de posición y velocidad de todas las partículas).
Congelamos la botella
 Metamos ahora la botella en un supercongelador donde bajamos su temperatura hasta -220ºC; haciendo así que el oxígeno se congele, se solidifique.
Metamos ahora la botella en un supercongelador donde bajamos su temperatura hasta -220ºC; haciendo así que el oxígeno se congele, se solidifique.
¿Qué ocurre en un sólido? Las partículas que lo componen ya no se mueven como en un gas, sino que están quietas siempre en la misma posición. Además, estas posiciones están más o menos definidas, es decir, una vez localizas un átomo de oxígeno, puedes saber aproximadamente donde estará el otro, pues en un sólido las partículas forman enlaces que las mantienen aproximadamente en su sitio. Por ello, podemos afirmar que un sólido está más ordenado que en un gas.
En el sólido, puesto que las partículas están quietas y más o menos ordenadas, el conjunto de velocidades y posiciones posibles será menor que en un gas. O, lo que es lo mismo, el número de microestados del oxígeno sólido en la botella es mucho menor que el número de microestados de un gas.
Un poco de matemáticas
Hemos visto que hay una relación entre el número de microestados y el orden. Cuantos más microestados tiene un macroestado, más desordenado está, porque más posiciones y velocidades distintas pueden tener sus partículas. Teniendo en cuenta esta relación entre microestados y macroestados, el genial físco Ludwig Boltzmann, a finales del siglo XIX, busca una magnitud física que dé cuenta del orden interno de un estado; y así define la entropía S de un macroestado como:
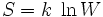
donde S es la entropía, k es un valor constante, y W es el número de estados.
¡Un momento! Dirá el lector menos acostumbrado a las fórmulas. ¿Qué significa esta ecuación? ¿Por qué decide Boltzmann que la entropía se defina así y no de otra manera?
La primera pregunta se resuelve fácilmente: lo que esta ecuación significa es que la entropía S de un estado físico crece con el número posible de microestados, W. La manera en la que S crece con W se ve muy bien en la siguiente gráfica:

La segunda cuestión es algo más técnica y simplemente diré que ésa es la única ecuación que cumple una serie de propiedades lógicas y necesarias.
Ropa tirada
 Para ver mejor la relación entre la entropía y el orden, apliquemos lo aprendido a algo más cotidiano. Intuitivamente, ¿qué está más ordenado? ¿la ropa dentro del cajón o la ropa desperdigada por la habitación? El macroestado «ropa dentro del cajón» tiene mucho menos microestados posibles que el macroestado «ropa desperdigada por la habitación» por la sencilla razón de que fuera del cajón existen muchas más posiciones posibles de la ropa; es decir, existen muchos más microestados. Por tanto, podemos decir que «ropa fuera del cajón» tiene más entropía que «ropa dentro del cajón».
Para ver mejor la relación entre la entropía y el orden, apliquemos lo aprendido a algo más cotidiano. Intuitivamente, ¿qué está más ordenado? ¿la ropa dentro del cajón o la ropa desperdigada por la habitación? El macroestado «ropa dentro del cajón» tiene mucho menos microestados posibles que el macroestado «ropa desperdigada por la habitación» por la sencilla razón de que fuera del cajón existen muchas más posiciones posibles de la ropa; es decir, existen muchos más microestados. Por tanto, podemos decir que «ropa fuera del cajón» tiene más entropía que «ropa dentro del cajón».
El desorden crece
En general, si quitamos restricciones a un sistema la entropía crece. Si no ponemos la ropa en el cajón y la vamos tirando por la habitación todo estará más desordenado. Si abrimos la botella de oxígeno a 25ºC el gas saldrá de la botella, expandiéndose, ocupando más espacio, y por ello aumentando el número de microestados posibles y su entropía. Si cogemos un saco de canicas y lo rasgamos todas las canicas caerán, desordenándose, aumentando sus posiciones posibles y aumentando la entropíá.
De hecho, hay una ley fundamental de la Naturaleza que dice que en todo proceso natural la entropía crece. Y ahora, que sabemos qué es la entropía, podemos decir que esto es así porque el número de microestados posibles es cada vez mayor.
¿Lo has entendido? ¡¡Pues a ordenar tu cuarto!!
PD: Esta anotación surge como consecuencia tardía y no gráfica de la petición que realiza Luis en su entretenido y creativo blog Entropía.



Una completa y amena explicación (virtud habitual en este blog) de la entropía termodinámica.
Yo alguna vez he bromeado diciendo: «ahora vengo, que voy a aumentar la entropía del universo», cuando tenía que ir al WC (por aquello de la irreversibilidad de los procesos de derrame 😉
Saludos y gracias por la referencia.
L.
Comentarios por Entropía — martes, 29 enero, 2008 @ 11:51 |
Delicioso… Da gusto leer una explicación así de un concepto que en cierta medida subyace al Universo. Le acerca a uno casi casi al rastro que deja el Universo al expandirse… ;o)
Pensando en ello, se podría decir que el ser humano en principio influye en el Universo deteniendo o frenando «El avance de la entropía» (me gusta como título de un cuento o una serie del espacio). Sin embargo, luego llega el cambio climático y la supuesta disminución de la entropía por obra y gracia del hombre, genera un desorden de otro tipo…
Uffffff! La duda: ¿el hombre es endoentrópico o exoentrópico? ¿Y si no paga impuestos?
Un saludito y gracias por el artículo
Comentarios por Carlos — martes, 29 enero, 2008 @ 12:59 |
¡Gracias por los alentadores comentarios!
Sobre si el hombre genera o revierte la entropía, supuestamente un organismo vivo, en su interior, revierte la entropía, sin embargo, para ello tiene que generar más entropía que la que revierte, con lo que el resultado neto es el aumento de entropía. Pague o no pague impuestos.
Manuel
Comentarios por Manuel — martes, 29 enero, 2008 @ 14:01 |
Creo que nunca me lo habían explicado de una manera tan sencilla, original y práctica a la vez… lástima que ya haya aprobado la físcoquímica porque te aseguro que el concepto de «Entropía» era de los que más me costaba entender… bueno y el de entalpía tambíen así que cuando puedas dedícame un post…
Gracias!
Comentarios por elblogdedani — sábado, 2 febrero, 2008 @ 18:24 |
se me cae la baba…. Maria
Comentarios por Maria — sábado, 2 febrero, 2008 @ 23:59 |
Hola!!!
Agradezco al teacher esta explicacion.
Los ejemplos bastaron para una buena comprension.
En mi mente hubo una buena retencion
la cual demostre en clases al dar mi pequeña explicacion.
Saludos: Vero.
Comentarios por Vero — lunes, 4 febrero, 2008 @ 21:38 |
He llegado a este blog debido a la entropía de mis vagabundeos navegadores.
Felicidades por el post. Te invito, cuando humildemente puedas, que de la misma manera nos puedas explicar los conceptos de incertidumbre y ruido, de cierta relación con la entropía.
Enhorabuena de nuevo!!!
Comentarios por roberasturias — martes, 26 febrero, 2008 @ 18:21 |
El principio de incertidumbre también está cargado de sutilezas muy interesantes. Espero poder abordarlo pronto.
Comentarios por Manuel — jueves, 28 febrero, 2008 @ 10:09 |
Realmente gracias, soy un arquitecto un poco alejado del mundo de las ecuaciones matemáticas y mas dedicado a lo perceptual, en recorridos y experiencias de las persona, y me facina este tema como un justificativo de q lo caótico o entropico (si es q existe el termino) permite una mayor cantidad de posibilidades de solucion a distintos problemas, que al final si se hacen realizables culminan en una obra armónica y ordenanda en ese estado de caos.
garcias mil..
Sae.
Comentarios por SAE — viernes, 7 marzo, 2008 @ 11:43 |
Muchas gracias, esto me sirvio demaciado !
tengo una dicertacion de la entropia i no tenia idea de lo qe era !
bueno ordenare mi piesa xD
Comentarios por Day — martes, 6 May, 2008 @ 4:19 |
yo tambien quede muy impresionado con la forma como lo definiste
muy interesante. sencillo
la descripcion de la formula tambien aunque algo obvia ayuda bastante decirla en palabras simples
Comentarios por Jojo — martes, 6 May, 2008 @ 15:33 |
hola…agradesco a mi profe por explicarme acerca de la entropia
Comentarios por carolay — miércoles, 14 May, 2008 @ 1:55 |
te amo mucho profesor macareno ere todo para mi
Comentarios por carolay — miércoles, 14 May, 2008 @ 1:56 |
Enhorabuena por tu blog. Pero tengo que darte una triste noticia: el desorden no siempre aumenta en el Universo: lo que aumenta es la entropía… y no es lo mismo. La ecuación de Boltzmann es muy útil para entender esta diferencia. Te recomiendo que leas este artículo de José A. Cuesta: La entropía como creadora de orden, publicado en la Revista Española de Física. También que visites la wikipedia para leer «irreversibilidad».
Piensa por un momento, si el desorden aumentara, ¿qué pasa cuando una proteína como la insulina se pliega espontáneamente en su conformación nativa? ¿Y con los coloides?
Un saludo.
Comentarios por Aida Ivars — jueves, 22 May, 2008 @ 10:14 |
Aida, antes de venir con tus aires aleccionadores, sería bueno que leyeras mejor lo que pretendes corregir. Conozco la violación del aumento de entropía de la vida, pero este texto no habla de eso.
Comentarios por Manuel — viernes, 23 May, 2008 @ 16:44 |
QUE LECCION DE TERMODINAMICA TAN SABROSA, ES DE ESAS LECTURAS QUE NUNCA QUIERO QUE SE ACABEN.
ES QUE NO PUEDO CREER LA FORMA TAN ESQUISITA EN QUE EXPLICAS ESTO.
MUCHAS GRACIAS.
YA HABIA LEIDO VARIAS COSAS SOBRE LA ENTROPIA EN MIS LIBROS, PERO EL CONCEPTO DE ENTROPIA NO LO ENTENDIA BIEN, SOY ALUMNO DE INGENIERIA QUIMICA Y YA COMENZABAMOS A RESOLVER PROBLEMAS RELACIONADOS CON LA ENTROPIA, PERO ME CUESTA MUCHO TRABAJO APLICAR LAS ECUACIONES SI NO CONOSCO EL CONCEPTO Y SI ADEMAS NO SE QUE ES LO QUE ESTA PASANDO EN EL SISTEMA.
MUCHAS GRACIAS Y FELICIDADES, HAY MUY POCAS PERSONAS CON ESA CAPACIDAD DE PODER EXPLICAR TAN BIEN CONCEPTOS QUE SON ALGO ABSTRACTOS
GRACIAS
Comentarios por HUGO — domingo, 1 junio, 2008 @ 6:44 |
Enucntro muy interesante la entropia, lo que me esplica que lo que la ley gobierna tambien preserva y debe haber una simultaneidad en sus aplicaciones en forma que el tiempo se considere como una fotografia. cuya presencia saca el pasado , el presente y el futuro. sino cumple con ello no puede haber justicia.
La informacion se puede lograr en la misma forma en un macro segundo, en un segundo aplicando el maximo y menor tiempo de una tarea a desarrollar. Quiere decir que el conocimiento no ocupa lugar pero una vez optenido cambia la cosa
Comentarios por Omar Fill — jueves, 10 julio, 2008 @ 17:08 |
Sobre este tema no tengo crítrcas pero sí se una cosa, que existe la perfección, el orden, mientras exista una unión absoluta de la particón interna y magnificiencia celestial.
Si todo tiene una explicación, solo que no la tenemos aun,solo la encontraremos en comunión y armonía con el espíritu.
Gracias nos vemos
Comentarios por ADRIAN — domingo, 20 julio, 2008 @ 14:20 |
Creo que Aida en su post solo dice que entropía y desorden no siempre están relacionados, no creo que hable de la violación del aumento de entropía por la vida. Hay sistemas en los que la mayoría de microestados llevan a un macroestado aparentemente más ordenado que el inicial. Por lo tanto aumenta la entropía y se ve más ordenado, un ejemplo es la estructura a gran escala del Universo.
Un saludo.
Comentarios por Algarrobo — martes, 22 julio, 2008 @ 13:06 |
Algarrobo, explícame eso de que la estructura del universo a gran escala tiene menos entropía que al principio, porque ¡es justo al revés!
A medida que el Universo se expande, hay más microestados posibles; por tanto, la entropía es necesariamente mayor.
Aquí verás una referencia:
http://es.wikipedia.org/wiki/Flecha_del_tiempo#Flecha_del_tiempo_cosmol.C3.B3gica
Comentarios por Manuel — miércoles, 23 julio, 2008 @ 18:18 |
Eso mismo, conforme evoluciona el Universo tiene más entropía que al principio pero aparentemente es más «ordenado». Al principio la distribución de materia es casi homogénea y después se van formando estructuras con lo que, en este caso, va un poco en contra de la idea intuitiva que tenemos de orden (es el único caso que conozco de este tipo).
En la Millenium Simulation (http://www.mpa-garching.mpg.de/galform/virgo/millennium/) se puede ver la evolución del Universo a gran escala. En la página anterior se ven una imágenes para distintos corrimientos al rojo o edades del Universo. Se ve como a z=18,3 el Universo es más homogéneo y conforme nos acercamos a la época actual (z=5,7 -> z=1,4 -> z=0) se van formando estructuras y filamentos, aparentemente es más ordenado aunque en realidad la entropía aumenta. Aunque, claro, esto es un caso extremo y raro.
Por cierto, el artículo está muy bien explicado. Enhorabuena.
Un saludo.
Comentarios por Algarrobo — viernes, 25 julio, 2008 @ 1:34 |
necesito un 4 de nota la otra semana y paso fisica 2 (por fin xD)
si lo paso!!
vengo a decirlo aca y a felicitar al creador de este articulo
sino.. xD no podre pq ya me abre suicidado
un saludo!
Comentarios por pckz — jueves, 31 julio, 2008 @ 4:40 |
Whoever wrote this, you know how to make a good artielc.
Comentarios por Jessie — jueves, 8 enero, 2015 @ 11:19 |
Hola, muy buena explicacion, de todas maneras me gustaria saber como se ocupa la entropia en alguna cosa de uso comun, osea en que podemos verla funcionar…..
muchas gracias
Saludos
Comentarios por giorgio vecco — martes, 23 septiembre, 2008 @ 23:18 |
oie se entiende de manera my buena tu agina x finm lo entendi, pero si me preguntas el orden en lkos tres estados de la materia segun desorden molecuklar creciente osea segun entropia seris: gas liquido y solido o me ekivoco???
Comentarios por jk — sábado, 1 noviembre, 2008 @ 19:38 |
[…] que ver si eso de “El Cambio” se queda o no en un mero lema. En cualquier caso el principio de entropía es firme y concluyente: “El universo tiende a distribuir la energía uniformemente”; es […]
Pingback por Costumbres « Librepensamientos y otras obscenidades — martes, 11 noviembre, 2008 @ 10:52 |
Podes quitar la nieve de mierda que cae cuando uno lee el articulo , que no se puede leer nada y me distrae
Comentarios por Juan — jueves, 11 diciembre, 2008 @ 18:07 |
Bastante entendible este concepto de entropía; aclarando además las inquietudes de «micro» y «macro» estados, pero hay una inquietud que planteo; la cual es el de no haber visto aclaración o explicación entre los procesos reversibles e irreversibles; siguiendo el ejemplo leído, la «la ropa en la habitación», si la ropa esta tirada en el piso, tu puedes ordenarlo y volver al ssitema al estado inicial o no (si no lo ordenas).
De mi comentario, pido aclara esto.
Comentarios por josué — miércoles, 24 diciembre, 2008 @ 15:14 |
Eccelente aportacion de la entropia.
pudieramos poner otro ejemplo de como funciona la entropia; digamos un ejemplo termodinamico, un comal pudiera serlo. Al calentar un comal para calentar tortillas, pudieramos concluir que el comal se haya en su momento de equilibrio, es decir esta calentado en su totalidad. No obstante, es posible que nos estuviesemos confiando demasiado puesto que el calor del comal seguiria propagandose a las moleculas del aire, lo cual mostraria que el comal aun no se a calentado en su totalidad.
Este calor del comal como es logico, seguiria propagandose a travez de la atmosfera, la cual despues de haber sido calentada, seguiria hacia el sistema solar para enseguida propagarse hacia el espacio profundo. Como sabemos el espacio esta en expancion.
Esto por supuesto nos ensena que el comal jamas lograria un equilibrio perfecto en su temperatura ya que simpre estaria perdiendo calor como resultado de un universo en expancion. Esto muestra que la ley de la entropia es algo asi como una bendicion, pues sin ella las cosas jamas se deteriorarian lo cual seria catastrofico para la vida humana. Imaginense una casa nueva que jamas se haga vieja? un carro nuevo que nunca se dteriore? un pantalon ecct. De modo que grcias a la entropia puedes cambiar un pantalon nuevo y mas bonito por uno viejo y pasado de moda no crees? Pues claro!!! Saludos.
Comentarios por fiuuu — lunes, 30 marzo, 2009 @ 0:32 |
Si hubiera leido un articulo así cuando tenia que rendir termodinamica hace ya algunos años, no me hubiera enredado entre las formulaciones de principios intentando explicar al tribunal la entropia y la segunda ley de la termodinamica. Lo hiciste bien simple, y me gustó. Luego de desvariar largo rato en el examen y declarar que «todos los procesos naturales son irreversibles» y llenar el pizarron con las ecuaciones de variacion de entropia de clausius y demas (medio de memoria) como que los convencí de que yo sabia. pero en realidad lejos estaba de agarrar el concepto. Me fue muy aclaratorio. Gracias
Comentarios por Max — viernes, 1 May, 2009 @ 5:31 |
ohh entendi por fin que es entropia despues de no escuchar a mi profesor de filosofia me dijo te sacaras un uno en prueba creo que no poreso gracias pr explicarla mucho mas entendible
Comentarios por Francisca ahumada — domingo, 10 May, 2009 @ 23:33 |
Gracias por la explicacion, muy comprensible
Jimena
Comentarios por Jimena — domingo, 15 noviembre, 2009 @ 15:50 |
Te felicito. Llegué por casualidad al sitio, y nunca pensé encontrar una explicación tan didáctica. Vale el talento
Comentarios por Rafael Muñoz — martes, 15 junio, 2010 @ 17:11 |
gracias, excelente la explicacion de los microestados.
Comentarios por javier — martes, 27 julio, 2010 @ 17:37 |
Muy bien explicado (micro y macro estados)
soy profesor de cs. sociales en Rosario, Argentina y mi idea es lentamente ir agregando algunas cosas de estas que son tan útiles y fáciles (¿) de vincular con las otras materias…
Comentarios por Pablos — lunes, 20 septiembre, 2010 @ 15:56 |
Muchísimas gracias, hoy comprendí la entropia gracias a ti, y ardo en deseos de compartirlo, te cito con gran gusto de encontrarte. Gracias.
Comentarios por Rosa — sábado, 15 enero, 2011 @ 0:23 |
[…] "CRITEO-300×250", 300, 250); 1 meneos Entendiendo la entropía inquietudes.wordpress.com/2008/01/27/entendiendo-la-entro… por cocowawa hace […]
Pingback por Entendiendo la entropía — miércoles, 21 marzo, 2012 @ 13:53 |
Uyy!! esot casi roza con una teoria del caos 😉 entender la aleotoridad
Comentarios por camilo — sábado, 24 marzo, 2012 @ 2:01 |
[…] Entendiendo la entropía: […]
Pingback por Momentos de Ocio! (Apto para Aburridos y Trasnoc… - Taringa! — domingo, 25 marzo, 2012 @ 7:35 |
la imposibilidad de definir conceptos,tal vez se relacione con nuestra mirada parcial, tangencial y a la vez capaz de transformar al objeto y a nosotros mismos
Comentarios por martha — sábado, 3 noviembre, 2012 @ 4:41 |
Fantásticamente explicado. No conseguí entender muy bien el concepto de entropía leyendo el artículo de Wikipedia pero sí con este post!. Me ha servido mucho, gracias por tomarte la molestia y compartirlo 🙂
Comentarios por Angel Abril Ruiz (@aabrilru) — domingo, 23 febrero, 2014 @ 12:03 |
Gracias
Comentarios por Horacio — sábado, 9 septiembre, 2017 @ 0:07 |
feo canalla
Comentarios por Ille — jueves, 14 septiembre, 2017 @ 14:03 |
expilcamelo mas despacio
Comentarios por juanfarn — jueves, 14 septiembre, 2017 @ 14:02 |
porfa
Comentarios por juanfarn — jueves, 14 septiembre, 2017 @ 14:03 |
ille feo
Comentarios por monsi — jueves, 14 septiembre, 2017 @ 14:06 |
amorfo de mierda
Comentarios por Ille — jueves, 14 septiembre, 2017 @ 14:07 |
monsi del reves es simon
Comentarios por monsi — jueves, 14 septiembre, 2017 @ 14:07 |